Los gases son fluidos altamente compresibles, es decir, disminuyen su volumen al someterlos a una presión determinada manteniendo constantes otros parámetros; son de baja densidad y su fuerza de cohesión molecular es casi nula, por lo que las moléculas de éste están muy separadas unas de otras; por ello son sus propiedades:
- Las moléculas pueden distribuirse por todo el espacio en el cual son contenidos.
- Ocupan completamente el volumen del recipiente que los contiene.
- No tienen forma definida.
- Pueden comprimirse fácilmente.
https://upload.wikimedia.org/wikipedia/commons/6/6d/Translational_motion.gif
Los gases manejan ciertas condiciones:
- Presión: relaciona la fuerza con la superficie sobre la cual actúa. Viene dada de la siguiente forma:
P= Fuerza/Área
Para medir la presión se utilizan las siguientes unidades: Pascal (Pa), Psi (Libra/pulgada cuadrada), Atm, mmHg, Torr, Bar, entre otros.
1 Atm -> 760 mmHg -> 760 Torr
1 Atm -> 14,7 Psi
1 Atm -> 101325 Pa
- Volumen: es el espacio que ocupa un cuerpo. Está dado en litros, mililitros, centímetros cúbicos, metros cúbicos, entre otros.
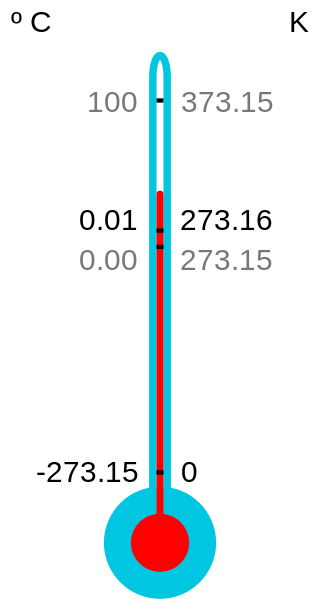
- Temperatura: es la medida de intensidad de calor y se mide con un termómetro; a medida que sea mayor la energía cinética de un gas, mayor será su temperatura. Sus unidades son: °Celsius, °Kelvin, °Farenheit. Kelvin es la escala absoluta.
https://upload.wikimedia.org/wikipedia/commons/thumb/6/60/CelsiusKelvin.svg/320px-CelsiusKelvin.svg.png
°C -> °K °K -> C° °C -> °F °F -> °C °K -> °F
°C + 273 °K - 273 °C * 1,8 + 32 0,56* (°F - 32) 1,8 * (°K - 273) + 32
°F -> °K
273 + 0,56 * (°F - 32)
Leyes de los gases ideales:
Las primeras leyes de los gases fueron desarrolladas gracias a que los científicos empezaron a darse cuenta de que en las relaciones entre la presión, el volumen y la temperatura, se podría obtener una fórmula que sería válida para todos los gases.
- Ley de Boyle: a temperatura constante, el volumen de una masa fija de un gas es inversamente proporcional a la presión que este ejerce; es decir, cuando aumenta la presión el volumen disminuye, cuando disminuye la presión el volumen aumenta. Se cumple la relación:
P1V1= P2V2
https://upload.wikimedia.org/wikipedia/commons/1/15/Boyles_Law_animated.gif
- Ley de Charles: a presión constante, el volumen y la temperatura son directamente proporcionales; es decir, al aumentar la temperatura el volumen aumenta, el disminuir la temperatura el volumen disminuye. Se cumple la relación de:
V1 T2= V2 T1
https://upload.wikimedia.org/wikipedia/commons/e/e4/Charles_and_Gay-Lussac%27s_Law_animated.gif
- Ley de Avogadro: a presión y temperatura constante, el volumen es directamente proporcional a las moles del gas; es decir, cuando aumenta el volumen las moles también, cuando disminuye el volumen las moles también.
Volumen/moles= constante de avogadro (Ka)
- Relación entre Boyle y Charles:
V1P1T2= V2P2T1
Ecuación de estado de los gases: relaciona las moles, la temperatura, la presión y el volumen.
Pv= nRT
P= presión
V= volumen
n= moles
R= constante ( 0,082 Atm* L/ mol * °K)
T= temperatura
Condiciones normales de un gas:
Presión: 1Atm
Temperatura: 273°K
Volumen molar: 1 mol de gas a condiciones normales ocupa 22,4 L
http://www.educaplus.org/gases/lab_boyle.html
http://www.educaplus.org/gases/lab_charles.html
http://www.educaplus.org/gases/ejer_boyle.html
http://www.educaplus.org/gases/ejer_charles.html
http://www.educaplus.org/gases/ejer_gas_ideal.html
http://www.educaplus.org/gases/ejer_avogadro.html
Por medio de estos links pondrán acceder a ejercicios de práctica. Esperamos que sean de su agrado.
http://www.educaplus.org/gases/lab_boyle.html
http://www.educaplus.org/gases/lab_charles.html
http://www.educaplus.org/gases/ejer_boyle.html
http://www.educaplus.org/gases/ejer_charles.html
http://www.educaplus.org/gases/ejer_gas_ideal.html
http://www.educaplus.org/gases/ejer_avogadro.html
Por medio de estos links pondrán acceder a ejercicios de práctica. Esperamos que sean de su agrado.


